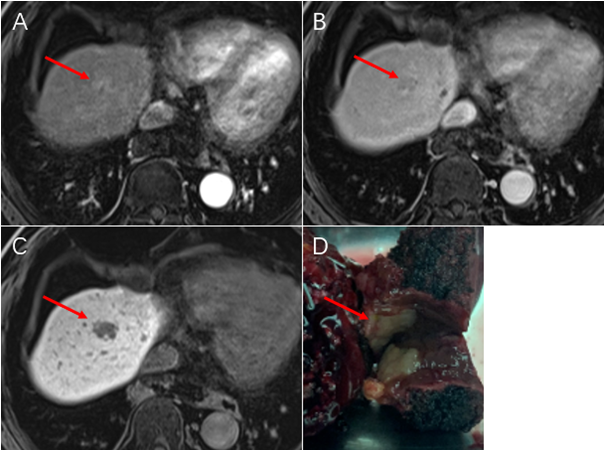
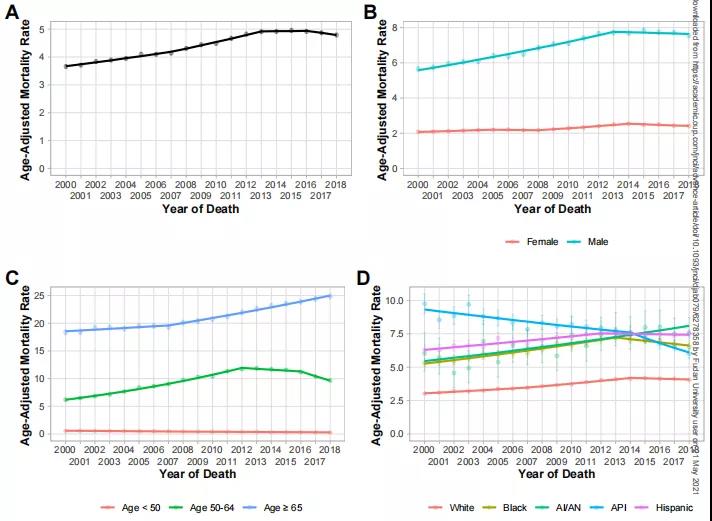
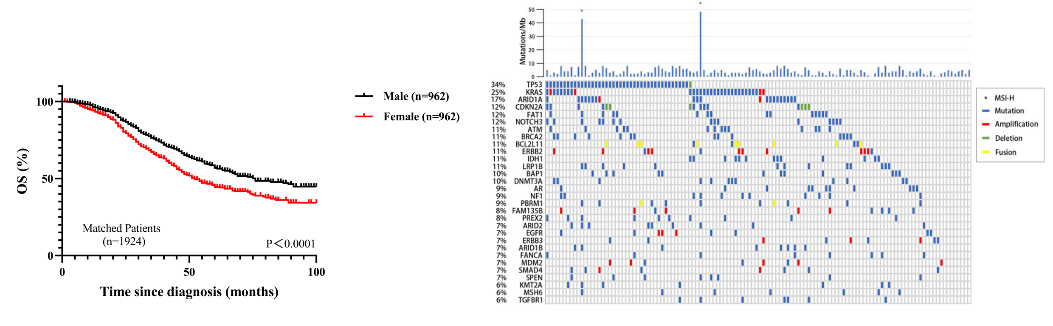
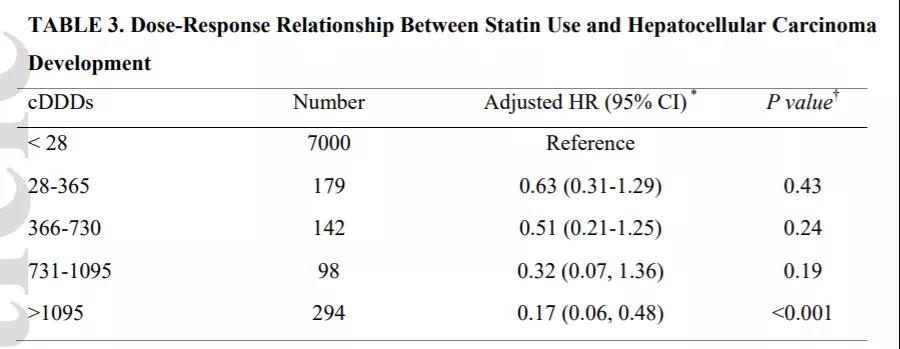
肝内胆管癌(intrahepatic cholangiocarcinoma, ICC)是起源于肝内二级胆管至末梢胆管上皮细胞的恶性肿瘤,发病率占原发性肝恶性肿瘤的10%~20%,恶性程度较高,预后差。同大多数恶性肿瘤一样,根治性外科手术是ICC治疗的首选方案,也是唯一的治愈手段,但是由于其早期症状不明显,发现时常常有局部浸润或转移,只有约35%的病人可行根治性手术。近年来,随着对肿瘤分子机制的深入研究,安全有效的治疗方案不断被发现,胆道恶性肿瘤进入了多学科综合治疗的新时代。 一、手术治疗: 根治性手术是针对可切除ICC治疗的首选方案,主要切除范围包括肝脏病灶切除和门脉淋巴结清扫。临床上评估患者是否可行手术治疗通常基于三个条件:(1)病人身体基本状况是否可耐受手术。(2)肿瘤的可切除性。(3)剩余肝功能是否可满足生理需求。其中,ICC的可切除性主要取决于肿瘤体积,数量(单发或多发)、淋巴结转移、血管侵犯、肝外转移等因素。其中,淋巴结转移状况与患者生存预后密切相关,约 1/3的病人在诊断时可有淋巴结转移,国内外指南多建议根据病灶的不同位置及淋巴引流行相应区域的淋巴清扫。此外,针对可能因肿瘤较大,多发或毗邻重要脉管等需要大范围肝切除而导致剩余肝体积不足的患者,联合肝脏离断和门静脉结扎的分次肝切除术(associating liver partition and portal vein ligation for staged hepatectomy, ALPPS)可通过促进肝脏增生后再切除肿瘤的二步肝切除术对此类病人实现转化切除的目的。 二、系统化疗: 目前胆管癌的一线标准化疗方案是吉西他滨加顺铂(GC方案)两联化疗。部分初始不可切除的病人,可通过新辅助化疗使肿瘤缩小降期来达到根治性手术的目的。有研究表明,新辅助化疗后根治性切除的病人可达到与初始可切除病人术后相似的预后效果。(1)但是,目前针对ICC的系统化疗方案的疗效并不理想,常常需要与靶向、免疫、介入等其他治疗方案联合应用。 三、靶向治疗: 靶向治疗是指针对已经明确的致癌位点,靶向药物选择性地与其结合发生作用的治疗过程。目前ICC中已明确的基因突变位点主要包括FGFR,IDH1,BRAF等,其中研究最多的靶点为FGFR融合突变位点,多项临床试验表明针对FGFR2融合突变的ICC病人使用FGFR抑制剂(如pemigatinib)可取得一定疗效,客观缓解率(ORR)在18.8%~35.5%,无进展生存时间(PFS)约为6个月。(2, 3)与化疗类似,ICC的单纯靶向治疗效果同样不尽如人意,常常需要与系统化疗或免疫治疗等治疗方式联合治疗。 四、免疫治疗: 免疫治疗是指通过调动机体自身的免疫系统来达到控制与清除肿瘤目的的一种治疗方法,目前以程序性死亡蛋白-1(PD-1)/程序性死亡蛋白配体-1(PD-L1)抑制剂为代表的免疫检查点抑制剂在多种肿瘤中取得较好的疗效。针对ICC的免疫治疗多采用联合治疗的方式,如免疫联合化疗、靶向或介入治疗等。一项来源于韩国的开放单中心、多队列的II期临床研究表明,度伐利尤单抗联合GC化疗方案可取得中位无进展生存期(mPFS)11.0个月,中位总生存期(mOS)18.1个月的良好效果。(4)与此同时,我中心目前开展的一项临床试验表明, 吉西他滨+奥沙利铂(Gemox)联合多纳非尼和替雷利珠单抗(PD-1人源性单克隆抗体,百济神州)方案可使入组患者中75 %的III期胆道恶性肿瘤患者肿瘤缩小,使无法手术的患者转化为可以进行手术,助力延长患者生存期。该研究采用独特的“免疫抑制剂+化疗+靶向药物”的联合治疗方案,评价其有效性、不良反应及安全性,为晚期胆道恶性肿瘤患者的治疗提供新思路。 除上述治疗方式外,局部治疗如消融,介入和放疗等也可以通过单独或与其他治疗方式联合来治疗ICC。如今,对于胆道恶性肿瘤的治疗已经进入了多学科综合治疗时代,通过多种治疗方案联合,可以达到相辅相成,提高疗效的结果。随着越来越多的联合治疗方案与新的治疗方式被挖掘发现,治疗效果被证实,ICC的治疗前景值得期待。 参考文献 1. Riby D, Mazzotta AD, Bergeat D, Verdure L, Sulpice L, Bourien H, et al. Downstaging with Radioembolization or Chemotherapy for Initially Unresectable Intrahepatic Cholangiocarcinoma. Ann Surg Oncol. 2020;27(10):3729-37. 2. Javle M, Roychowdhury S, Kelley RK, Sadeghi S, Macarulla T, Weiss KH, et al. Infigratinib (BGJ398) in previously treated patients with advanced or metastatic cholangiocarcinoma with FGFR2 fusions or rearrangements: mature results from a multicentre, open-label, single-arm, phase 2 study. Lancet Gastroenterol Hepatol. 2021;6(10):803-15. 3. Bahleda R, Italiano A, Hierro C, Mita A, Cervantes A, Chan N, et al. Multicenter Phase I Study of Erdafitinib (JNJ-42756493), Oral Pan-Fibroblast Growth Factor Receptor Inhibitor, in Patients with Advanced or Refractory Solid Tumors. Clin Cancer Res. 2019;25(16):4888-97. 4. Dyoab C, Khla B, Dwl A, Jy A, Tyka B, Jhbm B, et al. Gemcitabine and cisplatin plus durvalumab with or without tremelimumab in chemotherapy-naive patients with advanced biliary tract cancer: an open-label, single-centre, phase 2 study. 2022.